Total chemical synthesis of homogeneous folded and misfolded N-glycosylated IL-8 for investigation of UGGT recognition
[要約]
このページでは、細胞内で、正しい3次構造をもつ糖タンパク質を生合成される際に、その3次構造が正しいか、ミスフォールドしているかを管理するセンサー酵素UGGTの機能を、化学合成した糖タンパク質を用いて調べたことについて述べる。
UGGT
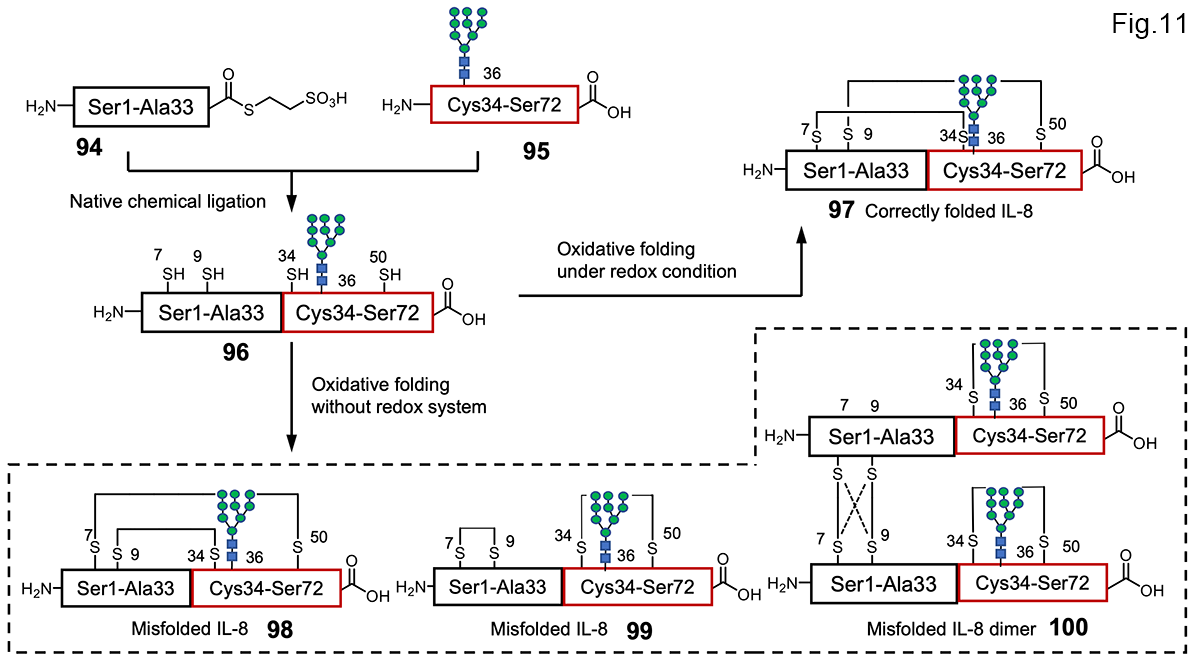
細胞内の小胞体で、正しくフォールディングした糖タンパク質が合成される。この際、酵素、UDP-Glucose glycoprotein glucosyltransferase (UGGT)は、糖タンパク質のフォールドの状態を管理するフォールディングセンサーとして働いている。小胞体内では、リボソームからタンパク質が作られるが、そこにAsn-X-Se/Thrという配列がでてくると、そのアスパラギンの側鎖の窒素原子に糖鎖(グルコース3つ、マンノース9つ、N-アセチルグルコサミン2つからなる高マンノース型糖鎖)が結合する。これはタンパク質の翻訳時修飾となる。 そして、これら糖タンパク質は、フォールディングを開始するが、天然型の3次構造になるものと、ミスフォールドする糖タンパク質が生じる。このタンパク質フォールディングの過程で糖鎖についていた3つのグルコースはグルコシダーゼで徐々に加水分解され、マンノース9つ、N-アセチルグルコサミン2つからなる高マンノース型糖鎖に変換される。 UGGTは、これらフォールディングの過程で、巧みに、ミスフォールド糖タンパク質を見つけだし、正しい構造へのリフォールディングを促進する。その際、UGGTは、ミスフォールド糖タンパク質を見つけると、その糖鎖末端にグルコースを1つ付ける。すなわち、小胞体内に生じる高マンノース糖鎖を持つミスフォールディングで、グルコースを1つもつものは、不良糖タンパク質としてタグをつけられたことになる。このようなプロセスを小胞体内糖タンパク質品質管理機構(Glycoprotein Quality Control:GQC)という しかし、UGGTがどのようにしてミスフォールド糖タンパク質を認識し、相互作用するのかについてはよくわかっていなかった。2012年、梶原グループは、UGGTによる認識パターンの解明のために、ミスフォールディングした単一構造の糖タンパク質インターロイキン-8(IL-8)97を化学合成した[32]。この研究でIL-8 97を合成標的に選んだ理由は、その三次構造がよく研究されていること、ジスルフィド結合の組み合わせを変えれば、ミスフォールド型が合成できると考えたからである。そこで、そして確立された合成戦略である(図11)。マンノース-9(M9)-高マンノース型のN型糖鎖を導入したIL8の全長糖ペプチドがNCLにより合成され、2 3種類のミスフォールド型糖タンパク質を合成することに成功した。そして、ミスフォールドした糖タンパク質表面に存在する疎水性面をUGGTが認識し、不良品という意味のグルコースを付加することを明らかにした。この分子認識によりミスフォールド体が発見され、リフォールドにより正しい構造の糖タンパク質が生産されていくと考えられる。